Assalamu'alaikum , ,
Asam, basa dan garam (Plassa). Dalam kehidupan sehari-hari kita sering berhubungan dengan senyawa asam, basa dan garam, bahkan hampir tiap hari kita selalu menggunakan senyawa yang bersifat asam maupun basa. Kita pun tak lepas dari garam karena hampir semua makan yang kita makan menggunakan garam. Untuk memahami tentang asam, basa dan garam mari kita bahas bersama-sama.
A. Asam
Senyawa asam banyak kita jumpai pada kehidupan sehari-hari. Semua senyawa asam mempunyai rasa masam/kecut. Rasa masam/kecut ini desebabkan oleh adanya senyawa yang bersifat asam. Buah-buahan memiliki rasa asam berkat adanya senyawa asam yang dikandungnya. Jeruk mengandung asam sitrat sedangkan anggur mengandung asam tartrat. Air susu yang basi mengandung asam laktat. Selain itu, senyawa asam dapat kita temukan juga dalam lambung dan darah. Dalam lambung terdapat asam klorida yang berperan pada pencernaan makanan serta dalam darah terdapat asam karbonat dan asam phosfat yang berperan pada pengangkutan makanan. Perhatikan tabel berikut.
Tabel 1.1 Beberapa Asam dan Sumbernya
1. Ciri-Ciri Asam
a. Rasanya asam
b. Dapat mengubah warna kertas lakmus biru menjadi merah
c. Mempunyai pH (derajat keasaman) kurang dari 7
d. Dapat menghantarkan listrik (termasuk larutan elektrolit)
e. Dengan logam tertentu dapat mengahasilkan gas hidrogen
f. Bersifat korosif atau merusak bahan-bahan benda-benda yang dikenainya
2. Peranan Asam Dalam Kehidupan
Tabel 1.2 Beberapa Asam yang Ada di Sekitar
Meskipun asam adalah senyawa yang sangat berguna, tetapi asam juga dapat menimbulkan berbagai kerusakan pada bahan-bahan yang dikenainya karena asam bersifat korosif. Salah satunya adalah peristiwa hujan asam. Berikut adalah beberapa dampak yang ditimbulkan oleh hujan asam:
a. mungubah pH tanah sehingga kondisinya tidak sesuai dengan tumbuhan dan mengakibatkan pohon/tanaman mati.
b. dapat menghilangkan unsur-unsur hara dalam tanah sehingga mengurangi kesuburan tanah.
c. mengubah pH air sehingga dapat mematikan ikan-ikan dan biota-biota air.
d. merusak bangunan, terutama yang terbuat dari batu pualam (karbonat dan logam).
B. Basa
Seperti halnya asam, basa juga banyak kita jumpai dalam kehidupan sehari-hari. Para ibu rumah tangga menggunakan abu gosok untuk mencuci piring. Basa dalam abu gosok dapat bereaksi dengan kotoran berupa lemak/minyak , sehingga menjadi larut. Sedangkan, untuk mencuci piring yang sangat berminyak perlu menggunakan sabun. Sabun dapat melarutkan lemak dan minyak. Para penderita magh selalu minum obat berupa magnesium hidroksida atau aluminium hidroksida.
1. Ciri-Ciri Basa
a. Pahit dan licin di kulit
b. Mempunyai pH lebih dari 7
c. Mengubah warna lakmus merah menjadi biru
d. Dapat menghantarkan listrik (termasuk larutan elektrolit)
e. Dapat menetralkan sifat asam
f. Bersifat kausatik atau dapat merusak kulit
Gambar 1.1 Sabun merupakan salah satu contoh zat yang bersifat basa
2. Peranan Basa dalam Kehidupan
Tabel 1.3 Beberapa Basa dan Fungsinya
C. Teori Asam Basa Arrhenius
Dari uraian di atas, salah satu ciri dari asam adalah senyawa yang berasa asam dan memerahkan lakmus biru sedangkan basa adalah senyawa berasa pahit dan licin di kulit serta dapat membirukan lakmus merah. Ciri tersebut belum dapat menjelaskan mengapa asam atau basa dapat menghantarkan listrik atau dikenal dengan istilah elektrolit. Untuk itu, Svante August Arrhenius mengajukan suatu konsep asam-basa yang di kenal sebagai teori asam-basa Arrhenius.
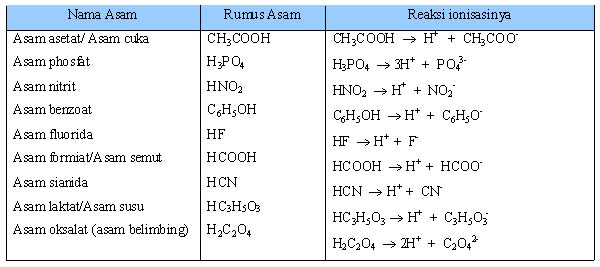
Asam adalah senyawa yang jika dilarutkan ke dalam air menghasilkan ion hidrogen (H+). Semakin banyak ion H+, semakin kuat sifat asamnya. Dengan demikian, dikenal asam kuat dan asam lemah. Asam kuat dalam air terionisasi sempurna (semua terurai menjadi ion), sedangkan asam lemah terionisasi sebagian (tidak semua terurai menjadi ion). Perhatikan tabel berikut.
Tabel 1.4 Asam Kuat dan Reaksi Ionisasinya
Tabel 1.5 Beberapa Asam Lemah dan Reaksi Ionisasinya
Basa adalah senyawa yang jika dilarutkan ke dalam air menghasilkan ion hidroksida (OH-). Semakin banyak ion OH-, semakin kuat sifat basanya. Dengan demikian, dikenal basa kuat dan basa lemah. Basa kuat dalam air terionisasi sempurna (semua terurai menjadi ion), sedangkan basa lemah terionisasi sebagian (tidak semua terurai menjadi ion). Perhatikan tabel berikut.
Tabel 1.6 Basa Kuat dan Reaksi Ionisasinya
Tabel 1.7 Beberapa Basa Lemah dan Reaksi Ionisasinya
D. Garam
Dalam kehidupan sehari-hari kita mengenal garam dapur yang biasa digunakan untuk bumbu masak. Garam dapur merupakan salah contoh dari garam menurut ilmu kimia.
Seperti halnya asam dan basa, garam juga memiliki peranan yang sangat penting dalam kehidupan. Perhatikan tabel berikut.
Tabel 1.8 Beberapa Garam dan Fungsinya dalam Kehidupan Sehari-Hari
Adapun ciri-ciri dari garam antara lain:
1. Dalam bentuk leburan (cairan) atau lelehan dapat menghantarkan listrik
2. Sifat larutannya dapat berupa asam, basa, atau netral tergantung jenis asam (kuat atau lemah) dan basa (kuat atau lemah) pembentuknya.
a. asam kuat dan basa kuat akan terbentuk garam yang bersifat netral
b. asam kuat dan basa lemah akan terbentuk garam yang bersifat asam
c. asam lemah dan basa kuat akan terbentuk garam yang bersifat basa
E. E. Tingkat Keasaman (pH)
Tingkat keasaman merupakan ukuran besar kecilnya pH yang menunjukkan skala keasaman dan kebasaan suatu larutan, angkanya sekitar 0 sampai dengan 14 dengan ketentuan sebagai berikut.
1. Larutan asam memiliki pH<7
2. Larutan basa memiliki pH>7
3. Larutan netral memiliki pH=7
F. Indikator
Indikator adalah bahan/alat yang digunakan untuk mengenali sifat suatu senyawa (asam, basa atau netral).
Macam-macam Indikator:
Macam-macam Indikator:
1. Indikator alami
Indikator alami diperoleh dari bagian tumbuhan berwarna dapat berupa bunga, daun, buah, biji, atau akarnya. Contohnya, kunir, bunga sepatu merah, kulit manggis, dan lain-lain.
Misalkan kulit manggis, kulitnya digerus sampai halus kemudian dituangi pelarut (alkohol) dan selanjutnya airnya dipisahkan melalui penyaringan. Ekstrak kulit manggis tersebut di teteskan pada senyawa yang bersifat asam atau basa, contohnya adalah larutan asam (HCl) atau basa (NaOH), maka:
- Pada larutan asam : terjadi perubahan warna dari ungu menjadi coklat kemerahan
- Pada larutan basa: terjadi perubahan warna dari ungu menjadi biru kehitaman
2. Indikator buatan
a. Kertas lakmus
b. Kertas indikator universal
c. Larutan
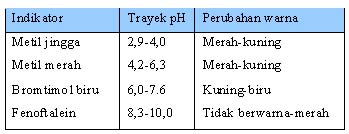
Tabel 1.10 Beberapa Indikator Larutan dan Perubahan Warnanya
d. pH meter/pH digital
G. Reaksi pada Asam, Basa, dan Garam
- Logam + asam -------> gas hidrogen + garam
Contoh: besi + larutan asam asetat ----------> gas hidrogen + besi(II) asetat
Fe(s) +2CH3COOH ----------> H2(g) +Fe( CH3COO)2(aq)
- Asam kuat + basa kuat ---------> garam (bersifat netral) + air
Contoh: Larutan asam klorida + larutan natrium hidroksida ---> larutan natrium klorida + air
HCl(aq) + NaOH(aq) ---> NaCl(aq) + H2O(l)
- Asam lemah + basa kuat ---> garam (bersifat basa) + air
Contoh: Larutan asam phosfat + larutan natrium hidroksida --> larutan natrium phosfat + air
H3PO4(aq) + 3NaOH(aq) --> Na3PO4(aq) + 3H2O(l)
- Basa lemah + asam kuat --> garam (bersifat asam) + air
Contoh: Larutan ammonium hidroksida + larutan asam sulfat --> larutan ammonium sulfat + air
2NH4OH(aq) + H2SO4(aq) --> (NH4)2 SO4(aq) + 2H2O(l)
- Oksida logam (oksida basa) + asam --> garam + air
Contoh: natrium oksida + larutan asam nitrat --> larutan natrium nitrat + air
Na2O(s) + HNO3(aq) ---> NaNO3(aq) + H2O(l)
- Oksida nonlogam (oksida asam) + basa ---> garam + air
Contoh: gas karbon dioksida + larutan kalsium hidroksida --> endapan kalsium karbonat + air
CO2(g) + Ca(OH)2(aq) ---> CaCO3(s) + H2O(l)
Saurchttp://memetmulyadi.blogspot.com
Soal Asam Basa dan Garam
1. Hitung pH larutan berikut
a. asam sianida 0,1 M (Ka=4,9 x 10-10)
b. KCN 0,1 M (Ka=4,9 x 10-10)
c. pH campuran dari 50 mL larutan pH 4 dan 50 mL larutan pH2
d. NH4Cl 0,05 M bila Kb NH4OH=2,0 x 10-5
e. Campuran 100 mL larutan HCN 0,1 M dengan 50 mL larutan NaOH 0,1 M (Ka HCN=4,9 x 10-10)
f. Campuran penahan dari CH3COOH 0,01 M dan NaCH3COO 0,1 M (Ka=1,76x10-5)
g. KOH 0,05 M
h. CH3COONa 0,02 M (Ka=1,8 x 10-5, Kw=10-14)
i. Campuran 100 mL HF 0,1 M dan 100 mL NaOH 0,05 M (Ka HF=6,6 x 10-4)
2. Hitunglah tetapan ionisasi basa lemah
a. MOH jika diketahui garam MNO3 0,01 M mempunyai pH 5,3
b. LOH 0,1 M yang mengurai dalam air sebanyak 2%
3. Hitunglah perubahan pH jika ke dalam 1 L campuran penahan yang terdiri atas asam sianida 1 M
(Ka=4,9 x10-10) dan natrium sianida 0,75 M, kita tambahkan
a. 0,1 mol HCl b. 0,1 mol NaOH
4. Sebutkan asam konjugasi atau basa konjugasinya
a. NH3 + H2O à NH4+ + OH- c. HC2H3O2 + H2O à H3O+ + C2H3O2-
b. SO42- dan HSO4-
5. Hitunglah tetapan ionisasi asam lemah
a. Bila 100 mL larutan HCl 0,001 M pH nya sama dengan 100 mL larutan HCOOH 0,01 M
b. Bila suatu asam HA 0,005 M terionisasi sebesar 5%
c. Asam lemah konsentrasi 1 x 10-2 dan pH nya 5,2
6. Sebutkan apakah garam berikut terhidrolisis sempuran atau parsial dan pH nya dan tuliskan penyusun garam (dari asam kuat, asam lemah, basa kuat atau basa lemah)
a. NaCl c. NaCH3COO e. NH4Cl g. KCl
b. NH4CN d. KCN f.Na2CO3 h. NaCN
7. Golongkan asam atau basa berikut sebagai asam atau basa kuat dan asam atau basa lemah
a. HClO3 c. HI e. H2SO4 g.NaOH
b. LiOH d.Al(OH)3 f. NH4OH h.H3PO4
8. Golongkan garam berikut bersifat asam atau basa
a. NH4I b. NH4Cl c. CH3COOK
d. KCN e. CH3COONa f. NaCN
9. Golongkan buffer berikut bersifat asam atau basa
a. Campuran 1 L NaOH 0,1 M dengan 0,5 L CH3COOH 0,5 M
b. 50 mL NH4OH 0,02 M dan 50 mL HCl 0,01 M
10 Campuran penahan yang terdiri dari 1 M asam asetat (Ka=1,81 x 10-5) dan garam natrium asetat mempunyai pH=4,74. Berapakah pH larutan tersebut setelah penambahan
a. HCl 0,01 M b. NaOH 0,01 M
11 Golongkan asam atau basa berikut sebagai asam atau basa monovalen atau polivalen
a. Ca (OH)2 b. C6H5COOH c.H2SO4 d.Ba(OH)2 e.H3PO4
Isilah B jika pernyataan benar dan S jika pernyataan salah
1. Asam konjugasi memiliki atom H lebih banyak daripada basa konjugasinya
2. Asam lemah memiliki nilai pKa yang besar
3. Dalam reaksi HCl + H2O à H3O+ + Cl- , kebasaan H2O lebih lemah dari Cl-
4.  Dalam reaksi H2PO4- HPO42- yang berlaku sebagai basa konjugasi ialah H2PO4-
Dalam reaksi H2PO4- HPO42- yang berlaku sebagai basa konjugasi ialah H2PO4-
5. Sifat amfiprotik air menyebabkan terjadinya autoionisasi air
6. Menurut teori Lewis, asam merupakan donor pasangan electron bebas
7. Semua asam basa menurut Bronsted-Lowry merupakan menurut asam basa menurut Arrhenius
8. Derajat keasaman pH larutan garam bergantung pada konsentrasinya
9. Contoh garam asam adalah campuran antara asam asetat dan NH4OH
10. Larutan garam NH4Cl 0,01 M jika diukur dengan pH meter akan memberikan pembacaan pH <7
11. pH larutan kalsium sulfat 0,01M sama dengan 7
12. Semakin besar konsentrasi H+ maka pH akan mendekati nilai 7
Berilah tanda silang
1. Jika 50 mL CH3COOH 0,1 M direaksikan dengan 5 mL NaOH 0,1 M dan diketahui Ka CH3COOH 1,0x10-5, maka pernyataan yang benar adalah…
a. CH3COONa mengalami hidrolisis sebagian dengan pH = 7 d. Larutan bersifat asam
b. CH3COONa mengalami hidrolisis sebagian dengan pH < 7 e. Larutan bersifat netral
c. CH3COONa mengalami hidrolisis sebagian dengan pH > 7
2. Campuran larutan berikut ini yang dapat membentuk larutan buffer adalah…
a. 100 mL HCN 0,1 M + 100 mL KOH 0,2 M d. 50 mL HCN 0,1 M + 50 mL KOH 0,1 M
b. 100 mL HCN 0,2 M + 100 mL KOH 0,1 M e. 100 mL HCN 0,1 M + 50 mL KOH 0,2 M
c. 100 mL HCN 0,2 M + 100 mL KOH 0,2 M
3. Suatu larutan ketika diberi indikator kuning alizarin (trayek pH 10,1-12,0 , warna asam kuning dan warna basa merah) menunjukkan warna jingga kemerahan maka pH larutan tersebut adalah…
a. <10,1 b. 10,1 - 11,05 c. 11,05 d. 11,05-12,00 e.>12
4. Tiga buah asam HA, HB, dan HC memiliki Ka berturut-turut 10-2 , 10-4 , 10-6 untuk membuat campuran dengan PH 4,5 paling baik digunakan campuran…
a. HC 0,1 M dan NaC 0,1 M c. HC 1 M dan NaC 1 M e. HB 0,1 M dan NaB 0,1 M
b. HB 1 M dan NaB 1 M d. HA 0,1 M dan NaA 0,1 M
5. Rumus penentuan konsentrasi H+ atau OH- di bawah ini yang sesuai untuk reaksi 25 mL NaOH 0,1 M + 25 mL HCN 0,1 M adalah…
a. [H+] = (Kw.Cg/ Kb)1/2 c. [H+] = (Kw.Cg/ Ka)1/2 e. [H+] = (Kw.Ka/ Kb)1/2
b. [OH-] = (Kw.Cg/ Ka)1/2 d. [OH-] = (Kw.Cg/ Kb)1/2
6. Dari beberapa indikator
Indikator
|
Trayek pH
|
Perubahan warna
|
Metil jingga
|
3,1-4,4
|
Merah-jingga
|
Metil merah
|
4,2-6,2
|
Merah-kuning
|
Bromtimol biru
|
6,0-7,6
|
Kuning-biru
|
Fenoptalein
|
8,3-9,6
|
Tak berwarna-merah
|
Suatu sampel air sungai diuji pH dengan ditetesi beberapa indikator:
- Dengan metil jingga berwarna jingga - Dengan metil merah berwarna kuning
- Dengan bromtimol biru berwarna biru - Dengan PP tak berwarna
Maka pH sungai diperkirakan sekitar…
a. 3,1 < pH < 7,6 c. 6,0 < pH < 8,3 e. 7,6 < pH < 8,3
b. 4,4 < pH < 7,6 d. 5,4 < pH < 6,0
7. Definisi asam menurut Lewis adalah…
a. Donor proton c. Spesi yang melepaskan ion H+ e. Donor pasangan elektron
b. Akseptor proton d. Akseptor pasangan electron
8. Garam yang terbentuk dari asam kuat dan basa kuat adalah…
a. NaCH3COO b. Na2CO3 c. KCl d. NaCN e. NH4Cl
9. Indikator A memiliki trayek pH = 6,0 – 7,5. Di atas trayek pH indikator berwarna kuning dan di bawah trayek pH berwarna biru. Jika ke dalam larutan HCl 0,001 M ditambahkan indikator A maka larutan akan berwarna
a. Merah b. Kuning c. biru d. putih e. hijau
10. Yang termasuk asam Lewis adalah…
a. CaO b. MgO c. Al3+ d. F- e. Cl-
11. Daya tahan larutan buffer akan semakin tinggi jika…
a. Ca<Cg b.(Ca<Cg)=0 c. Ca>Cg d. (Ca<Cg)<1 e. Ca=Cg
12. Jika ke dalam larutan buffer NH4OH + NH4Cl ditambahkan suatu basa (NaOH) maka akan terjadi peningkatan konsentrasi…
a. Cl- b. Na c. NH4OH d. NH4Cl e. HCl
13. Garam-garam berikut yang bersifat asam ialah…
a. NH4I dan NH4Cl b. NH4Cl dan KCl c. KCN dan NaCN
d. NH4I dan KI e. KCl dan KI
Kunci Jawaban Materi Kimia : Asam, Basa dan Garam:
1. a. 5,15 c. 2,29 e.9,3 g. 12,7 i. 3,18 II. 1.B 7.S III. 1.C 7.D 13.A
b. 11,15 d. 5,3B f. 5,75 h. 8,52 2.B 8.T 2.B 8.C
2. a. 4x10-6 b. 4x10-5 B 3.S 9.S 3.D 9.C
3. a. pHawal=9,18 pHakhir=9,28  pH=0,1 4.S 10.B 4.D 10.C
pH=0,1 4.S 10.B 4.D 10.C
b. pHawal=9,18 pHakhir=9,08  pH=-0,1 5.B 11. B 5.B 11.E
pH=-0,1 5.B 11. B 5.B 11.E
5. a. 1x10-4 b.1,3x10-5 c.4x10-9 6.S 12.S 6.E 12.C
YA.. Mungkin cuma segitu saja yang bisa saya sampaikan. Senyawa asam basa sendiri sudah banyak di kehidupan kita. Misalnya saja sabun yang merupakan senyawa basa. Kenali dan pahami senyawa asam basa biar bisa dengan mudah di kerjakan dengan baik dan benar.
Mengingat materi ini bukan cuman pengerjaan saja. Tapi juga perhitungan dan hafalan dan ketelitian dalam pengerjaannya. :c:
Wassalamu'alaikum . . .
Wassalamu'alaikum . . .
Tag :
Education













1 Komentar untuk "Materi Kimia : Asam, Basa dan Garam"
makasih gan .. artikel kimianya sangat bermanfaat sekali
Komentarlah Dengan Baik dan Benar. Jangan ada SPAM dan beri kritik saran kepada blog ILMU DUNIA DAN AKHIRAT.
Mengingat Semakin Banyak Komentar SPAM maka setiap komentar akan di seleksi. :)
"Barangsiapa beriman kepada Allah dan hari akhir hendaklah berbicara yang baik-baik atau diam." (HR. Bukhari)
>TERIMA KASIH<